
树突状细胞(dendritic cells, DC)在免疫系统中发挥重要作用,它就像咖啡的“伴侣”一般能提供强大的支持性功能, 它们能够将肿瘤相关抗原交叉呈递给T淋巴细胞,并引发一系列免疫反应,因此具有充当“细胞”疫苗的强大潜力。嵌合抗原受体T(CAR-T)细胞可以通过CAR分子识别肿瘤表面的抗原,从而很好地发挥抗肿瘤的作用,目前已有13款针对血液肿瘤的CAR-T细胞产品上市,给血液瘤患者带来了福音。然而,由于肿瘤内部不成熟的免疫细胞浸润以及肿瘤微环境(tumour microenvironment, TME)会像“幽灵”一般, 严重限制免疫细胞发挥正常功能,为CAR-T细胞治疗实体瘤带来了极大的挑战。
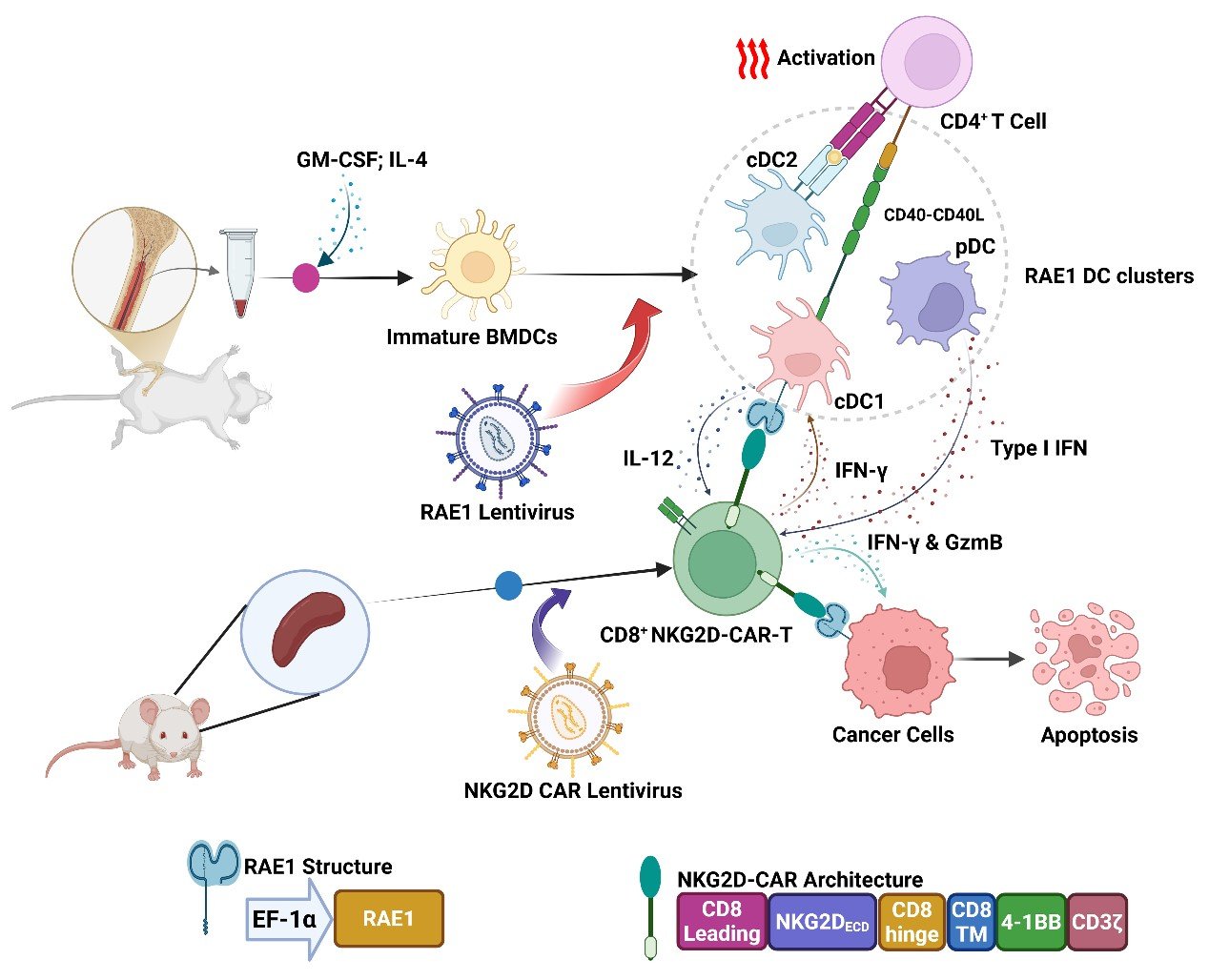
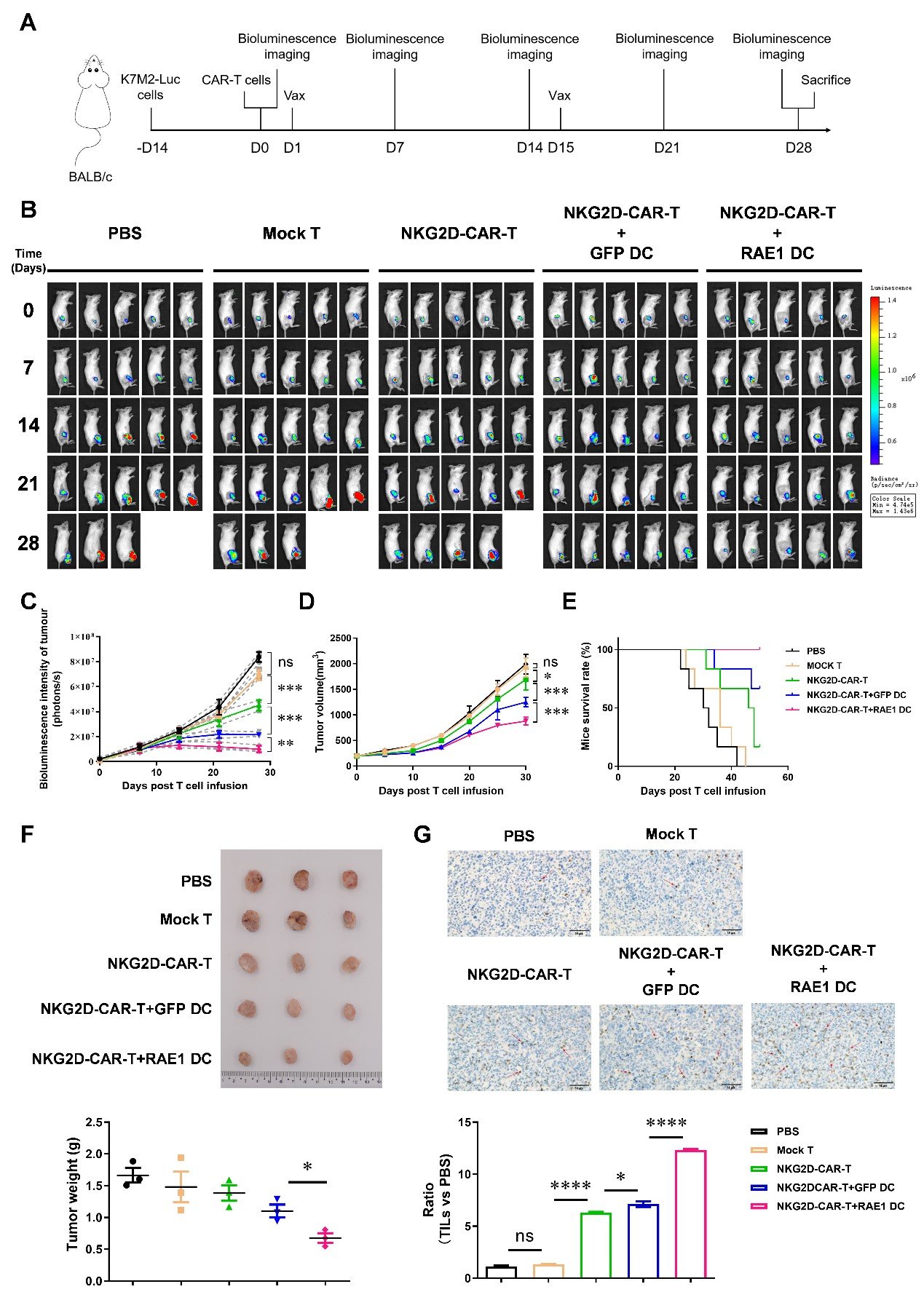
江文正教授团队利用联合免疫治疗策略,采用CAR-T细胞结合DC疫苗增强其抗肿瘤作用。DC疫苗是由小鼠骨髓细胞经GM-CSF/IL-4刺激形成不成熟的DC细胞(cDC1, cDC2和pDC),经过慢病毒感染而装载NKG2D配体RAE1(ribonucleic acid export 1)形成特定的成熟DC疫苗。CAR-T细胞是由小鼠脾脏中分离的T细胞经NKG2D-CAR慢病毒感染形成NKG2D-CAR-T细胞,在DC疫苗的作用下,增强了NKG2D-CAR-T细胞的毒性、增殖以及向中央记忆表型转变的能力,促进了IFN-γ、GzmB与IL-12等细胞因子的分泌,在体内与体外研究中均发挥了更强大的杀伤肿瘤细胞的能力。
临床试验中针对DC疫苗的改造与修饰主要通过肿瘤相关抗原(tumor-associated antigen, TAAs)装载或抗原 mRNA 脉冲的方式进行,该研究突破了这些方式只能激活MHC-I+ cDC1向CD8+ T细胞呈递抗原的局限性。以混合DC亚群所形成的疫苗和T细胞能产生“cross talk”功能, 从而进一步提高CAR-T治疗效果和减少肿瘤免疫逃逸,为实体瘤的治疗提供了新的思路。
该研究揭示了慢病毒感染装载RAE1(ribonucleic acid export 1)形成成熟且活化的DC疫苗,增强了NKG2D-CAR-T细胞的细胞毒性、中央记忆表型转变、细胞活化、细胞增殖和存活,研究结果为CAR-T和DC疫苗联合疗法在实体肿瘤治疗中的应用展现出了令人欣喜的前景。

